近期,华测实验室接到客户咨询,询问在《中华人民共和国药典》2025年版发布后,应如何开展因方法标准换版导致的检测能力变更工作。针对这一问题,华测实验室与客户展开了深入探讨,现将相关讨论内容整理分享,以供大家参考。
Q:(标准)变更后需要做哪些工作?
A:首先,应先尽快购买合规途径来源(如中国医药科技出版社等)的新标准-《中华人民共和国药典》2025年版纸质本;
依据CNAS-WI14-01《实验室认可评审指导书》5.11.2条款规定,一般情况下,讨论稿、草案等未定稿标准不予推荐认可。实验室如采用讨论稿、草案等非合规途径(如网上下载、朋友赠送等)获得的标准文本,评审时可不予以推荐。

其次,应尽快启动标准变更分析和新检测标准的方法验证工作;
依据
a.CNAS-CL01:2018之7.2.1.5条款规定,如果发布机构修订了方法,应在所需的程度上重新进行验证。
b.CNAS-CL01-A002:2020/CNAS-CL01-A026:2023之7.2.1.5条款规定,当标准方法发生变更涉及到技术能力发生变化,如检测方法原理、仪器设备、环境设施、操作方法、方法适用范围等,需要通过技术验证重新证明正确运用新标准的能力。
再次,在新标准实施前应及时修订实验室质量体系文件(如检测方法作业指导书)。
依据CNAS-CL01:2018之7.2.1.2条款规定所有方法、程序和支持文件,例如与实验室活动相关的指导书、标准、 手册和参考数据,应保持现行有效并易于人员取阅(见8.3)。
同时提醒各检测机构,需要时,应参加新标准《中华人民共和国药典》2025版的外部质量控制活动(如测量审核,实验室间比对)
Q:(标准)变更后标准变更分析应如何做?
A:我们以《中华人民共和国药典》2020版三部通则1143细菌内毒素检查法 方法2 光度测定法 显色基质法 动态显色法 和《中华人民共和国药典》2025版三部通则1143细菌内毒素检查法 光度检测技术 方法5 动态显色法 作案例来给大家分析下两者标准变更分析如何做?
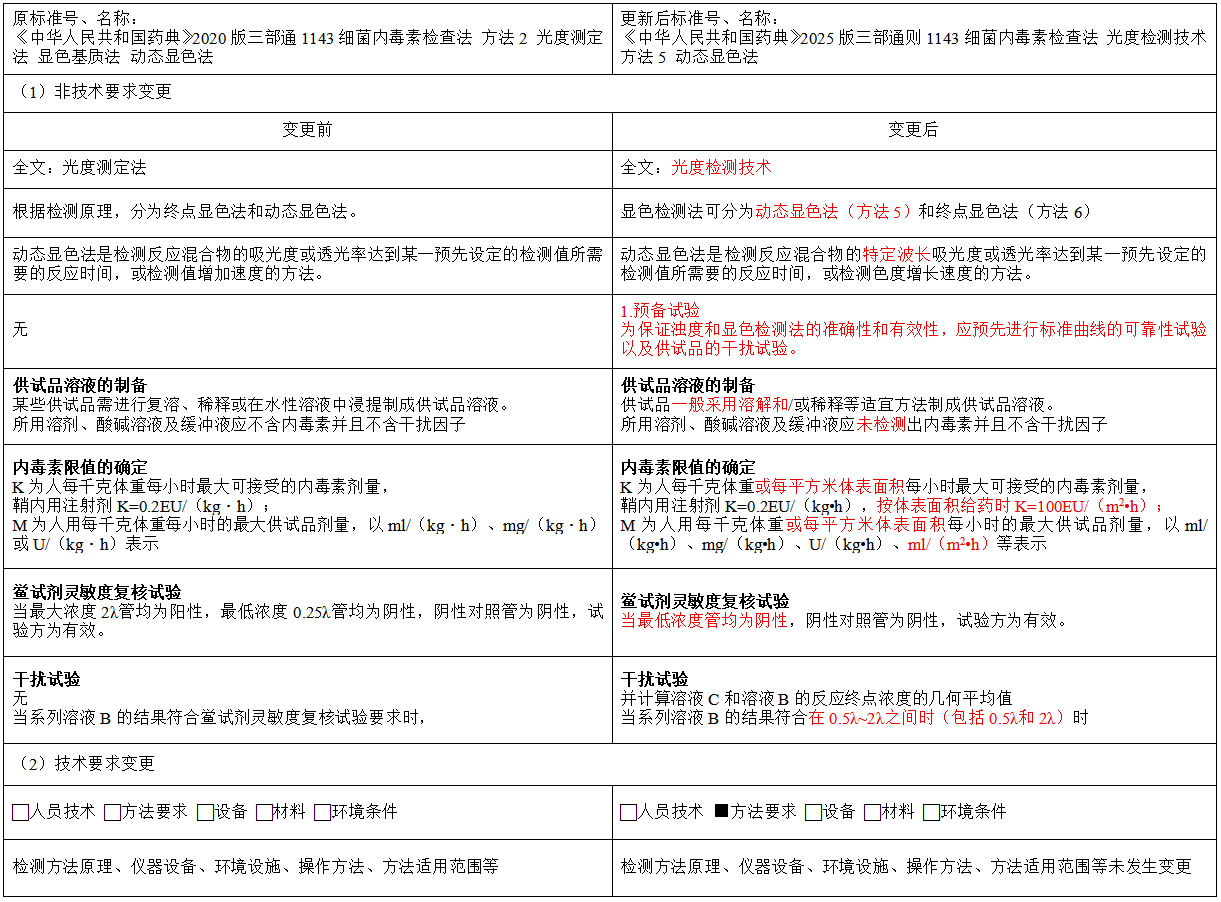
综上,在实际操作中,我们对照《中华人民共和国药典》2020版和2025版相关通则内容在文字编辑、检测方法原理、仪器设备、环境设施、操作方法和方法适应范围等方面对两者进行了比较,发现全文除了文字编辑(定义/完善描述/判定)等发生了文字变更外,依据CNAS-CL01-A002:2020/CNAS-CL01-A026:2023之7.2.1.5条款进行核查,其技术能力并未发生实质上变化。
Q:(标准)变更后向CNAS申报标准能力变更的时机?
A:依据CNAS-RL01:2025《实验室认可准则》之9.1.1变更通知条款规定,获准认可实验室如发生下列变化,应在20个工作日内通知CNAS秘书处:
c)认可范围内的检测/校准/鉴定依据的标准/方法、重要试验设备、环境、检测/校准/鉴定工作范围及有关项目发生改变;
由此,获准认可实验室应及时向CNAS提交(标准)变更任务。
华测实验室提醒各检测机构,在完成了标准文本购买、标准变更分析、标准方法验证、质量体系文件(检测方法作业指导书)修订、《中华人民共和国药典》2025版若干典型检测次数和(需要时)外部质量控制(如测量审核、实验室间比对)记录后,即可向CNAS申请标准变更任务。